标的公司:Reata Pharmaceuticals,Inc.(NASDAQ:RETA)
Reata Pharmaceuticals,Inc.(RETA)宣布美国食品和药物管理局(FDA)心血管和肾脏药物委员会(Cardiovascular and Renal Drugs Advisory Committee)关于bardoxolone methyl (bardoxolone) 治疗Alport综合征引起的慢性肾病(“CKD”)会议的结果。
委员会对提供的证据是否证明bardoxolone能有效减缓Alport综合征患者CKD的进展以及其益处大于风险的问题投了反对票。
公司目前的交易价格跌入2018年5月以来的最低水平。

虽然FDA不受投票结果约束,但在做出批准决定之前,通常会遵循其建议。RETA表示,将继续与FDA合作,在2月25日PDUFA日期之前提交额外的数据和信息。
Alport综合征
Alport综合征是一种罕见的CKD遗传形式,由编码IV型胶原的基因突变引起,IV型胶原是肾脏肾小球基底膜的主要结构成分。Alport综合征影响儿童和成人。患者的肾脏逐渐失去从血液中过滤废物的能力,这可能导致终末期肾病,需要进行慢性透析治疗或肾移植。在病情最严重的患者中,大约50%在25岁时进展到透析,90%在40岁时进展到透析,近100%在60岁时进展到透析。根据Alpple综合症基金会,Alpple综合症影响美国大约30000到60000人。目前还没有批准治疗Alport综合征引起的CKD的疗法。
Bardoxolone
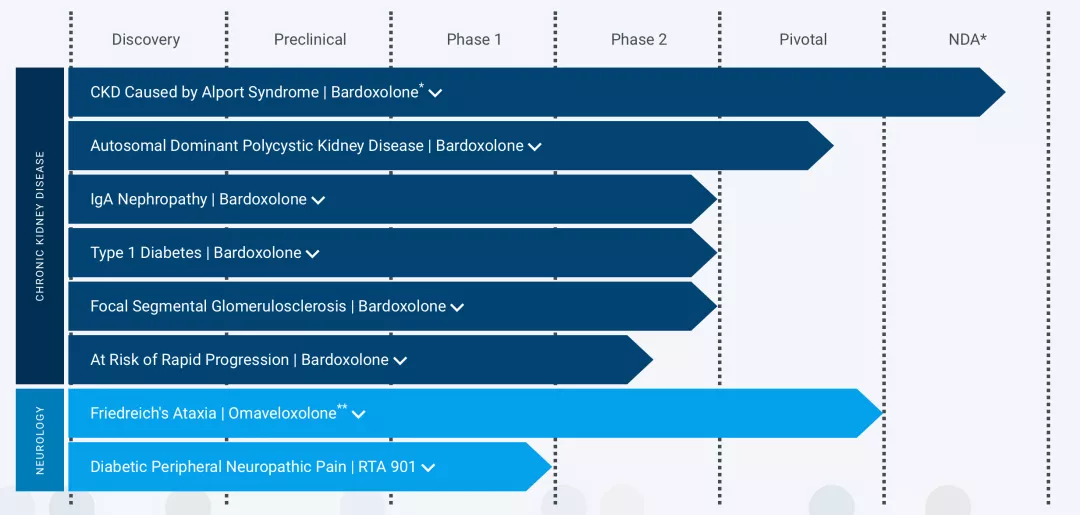
Bardoxolone是每天口服一次的研究性Nrf2激活剂,Nrf2是一种转录因子,通过恢复线粒体功能、减少氧化应激和抑制促炎症信号传导诱导促进炎症解决的分子途径。FDA已批准Bardoxolone为孤儿药,用于治疗阿尔波特综合征和常染色体显性多囊肾病(“ADPKD”)。
除了治疗Alport综合征引起的CKD的主要3期研究外,bardoxolone目前正在FALCON,治疗ADPKD引起的CKD的3期研究;MERLIN,治疗有快速进展风险的CKD患者的2期研究;和AYAME,与Kyowa Kirin Co.,Ltd.(Kyowa Kirin)在日本的糖尿病肾病的3期合作研究。巴bardoxolone治疗对由ADPKD、IgA肾病、局灶性节段性肾小球硬化和1型糖尿病引起的CKD患者的2期研究已有积极结果。
目前正在审查中的申请包括,向欧洲药品管理局提交bardoxolone治疗阿尔波特综合征引起的CKD的上市许可申请(Marketing Authorization Application)。以及Kyowa Kirin向日本卫生、劳动和福利部提交的bardoxolone改善Alport综合征患者肾功能的NDA。
Reata
Reata是一家临床阶段的生物制药公司,通过靶向参与细胞代谢和炎症调节的分子途径,为患有严重或威胁生命的疾病的患者开发新的治疗方法。RETA的两个最先进的临床候选药物bardoxolone和omaveloxolone靶向转录因子Nrf2,该转录因子通过恢复线粒体功能、减少氧化应激和抑制促炎症信号传导来促进炎症的解决。
未经允许不得转载:美股开户者 » Reata:-45%,FDA咨询委员会就bardoxolone治疗Alport综合征引起CKD持反对意见
 美股开户者
美股开户者