标的公司: Samsara Vision, Inc(NASDAQ:SMSA)
Samsara Vision是一家医疗器械公司,专注于眼科黄斑病变的晚期治疗,其产品线包括第一代植入微型镜片(WA IMT),新一代小切口植入微型镜片(SING IMT)和Tsert植入系统。该公司计划1月22日在纳斯达克上市,交易代码SMSA,发行价约$5-$7,募资额约3354万美元,其中1200万美元计划用来支持SING IMT在欧洲的商业化推广,200万美元进行产品研发,500百万美元计划用来推进SING IMT在美国的监管批准。
眼科医生通过用Samsara Vision的植入式镜片取代眼睛的天然晶状体,该镜片在摘除眼睛的天然晶状体后放置在囊袋中。一旦进入眼睛,该装置像一个固定的长焦镜头,将眼睛前面的图像放大到正常尺寸的大约2.2-2.7倍。

公司第一代产品WA IMT在2010年7月被FDA批准上市,适应症为65岁及以上、被诊断为晚期AMD、最佳矫正距离视力为20/160至20/800的人,每个WA IMT的费用为15750美元。截至目前植入超600个患者。由于手术复杂,且切口较大(约12mm)缝合较多,对眼科医生操作要求高,使其无法被广泛采用。

公司研发研发的下一代SING IMT由灵活和可折叠的硅胶触觉支持,SING IMT被预装在一个注射器系统内,通过一个较小的切口植入(约6.5mm),术后恢复更快。注射器系统还降低了对外科医生的操作要求和时长,SING IMT预计可将平均手术时间减少一半(包括切除病人的白内障),相比WA IMT缩短超过60分钟。在爱尔兰进行的9个SING IMT手术中,内皮细胞密度(ECD)损失低于8%,与WA IMT的23%-25%的损失相比具有优势,此外SING IMT患者还报告了更快的恢复时间。公司认为这是影响安全性和临床试验主要终点的一个关键因素。
SING IMT在2021年获得CE 认证,可在欧洲进行商业化推广。在美国SING IMT被归类为三类医疗设备,因此不能在美国销售,除非提交上市前批准(PMA)后FDA批准该设备。FDA已确认如需获得PMA需进行临床试验,公司在与FDA的讨论中提出预计将招募100位患者,临床主要终点为随访12个月后相比WA IMT的ECD损失(23%-25%),SING IMT在ECD损失的改善和视觉功能表现。公司计划在2022年上半年提交IDE(nvestigational Device Exemption)后开始研究。公司预计SING IMT未来在美国的定价约在$15,000,欧洲为$10,000美元,亚太地区为$5,000美元。
2020、2021年前3季度财务表现
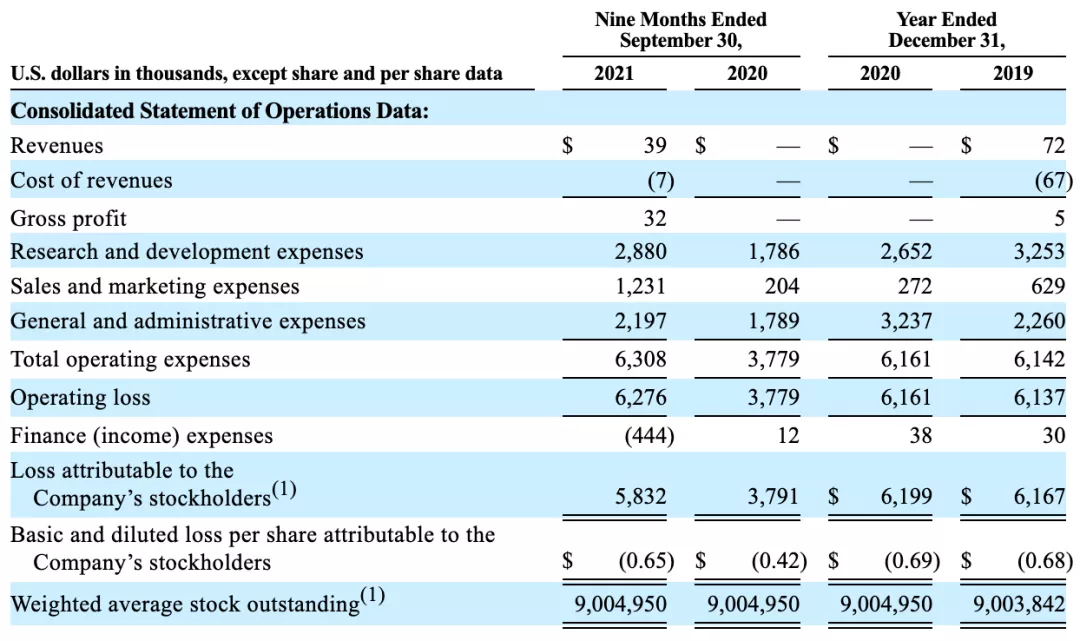
现金、现金等价物:$6.1M (As of Sept 30, 2021)
未经允许不得转载:美股开户者 » Samsara Vision:眼科医疗器械公司申请IPO上市
 美股开户者
美股开户者